Pengertian Tabel Periodik Tujuan Cara menghafal – Tabel periodik adalah tabel yang menampilkan unsur-unsur kimia yang pada awalnya diatur dalam urutan berat atom, namun sekarang sesuai dengan nomor atom. Tabel periodik memiliki baris (kiri ke kanan) dan kolom (atas dan bawah).
Tiap-tiap baris memiliki karakteristik tersendiri. Misalnya, berilium (Be) dan magnesium (Mg) ditemukan dalam kolom dua dan berbagi kesamaan tertentu sementara kalium (K) dan kalsium (Ca) dari baris keempat memiliki karakteristik yang berbeda dari baris kedua.
Tabel periodik disusun dalam urutan meningkatnya nomor atom. Unsur-unsur kimia dengan sifat yang serupa (karakteristik) disusun dalam kolom yang sama (disebut golongan), dan unsur-unsur dengan jumlah yang sama dari kulit elektron disusun dalam baris yang sama (disebut periode).
Perbedaan Periode dan Golongan
Periode adalah:
Merupakan lajur horizontal pada tabel periodik.
Terdiri 7 periode. Masing-masing periode menyatakan jumlah/banyaknya kulit atom unsur-unsur yang menempati periode-periode tersebut.
Golongan adalah :
Sistem periodik terdiri atas 18 kolom vertikal yang terbagi menjadi 8 golongan utama (golongan A) dan 8 golongan transisi (golongan B).
Unsur-unsur yang mempunyai elektron valensi sama ditempatkan pada golongan yang sama.
Manfaat tabel periodik
Berikut ini adalaah manfaat kenapa unsur-unsur kimia tersebut dibuat dalam sistem tabel periodik:
- Tabel tersebut menunjukkan mengapa unsur-unsur kimia berada dalam golongan yang memiliki karakteristik yang sama. Tabel tersebut juga menunjukkan bagaimana dan mengapa sifat-sifat unsur kimia berbeda dalam periode yang sama.
- Memprediksi harga bilangan oksidasi dari nomor golongan suatu unsur, baik unsur utama maupun unsur transisi, menyatakan bilangan oksidasi tertinggi yang dapat dicapai oleh unsur tersebut. Hal ini berlaku bagi unsur logam dan unsur non logam.
- Mencari bilangan oksidasi terendah yang dapat dicapai oleh suatu unsur bukan logam adalah nomor golongan dikurangi delapan. Adapun bilangan oksidasi terendah bagi unsur logam adalah nol. Hal ini disebabkan karena unsur logam tidak mungkin mempunyai bilangan oksidasi negatif.
Tujuan pengelompokkan unsur
Untuk memudahkan dalam mempelajari penggabungan unsur dengan unsur lain dan membentuk senyawa.
Sejarah Perkembangan Sistem Periodik Unsur
Saat ini, telah ditemukan 116 unsur. Sebagian besar merupakan unsur yang ditemukan di alam dan berjumlah 92, sedangkan unsur lainnya merupakan unsur buatan. Untuk mempelajari tiap-tiap unsur, pembahasannya sangat kompleks karena sifat-sifat unsur bervariasi satu dengan lainnya. Karena itu, unsur-unsur tersebut perlu dikelompokkan supaya mudah dalam mempelajarinya.
Pengelompokkan unsur didasarkan pada sifat yang dimilikinya. Pengelompokkan yang paling sederhana berdasarkan sifat logam dan bukan logam. Kemudian, ada pengelompokkan unsur menurut Lavoisier, disusun Triad Dobereiner, sistem Oktaf Newlands, sistem periodik Mendeleev, sampai pada sistem periodik modern yang digunakan sekarang.
1. Pengelompokkan Unsur berdasarkan Sifat Logam dan Bukan Logam
Para Ilmuwan dari Arab dan Persia biasanya mengelompokkan unsur menurut sifat logam dan bukan logamnya.
Ada beberapa penjelasan menurut pengelompokkan unsur berdasarkan sifat logam dan bukan logam, yaitu :
1) Secara fisik, umumnya unsur logam bersifat padat, mengilap, dapat regang, dapat ditempa, mempunyai kerapatan yang tinggi serta penghantar panas dan listrik yang baik.
2) Secara kimia, umumnya unsur logam cenderung melepas elektron dan mudah bereaksi dengan oksigen.
3) Unsur bukan logam memiliki sifat-sifat yang berlawanan dengan unsur logam.
2. Pengelompokan Unsur Menurut Lavoisier
Lavoisier (lahir di Paris, 26 Agustus 1743 – meninggal di Paris, 8 Mei 1794 pada umur 50 tahun) adalah orang yang bertanggungjawab memberikan nama kepada oksigen pada tahun 1774. Perkataan oksigen terdiri dari dua kata Yunani, oxus (asam) dangennan (menghasilkan) Lavoisier yang bernama lengkap Antoine Laurent de Lavoisier (1743-1794) adalah seorang kimiawan asal Prancis yang kali pertama mengelompokkan unsur.
Pada 1789, Antoine Lavoiser mengelompokan 33 unsur kimia. Pengelompokan unsur tersebut berdasarkan sifat kimianya. Unsur-unsur kimia di bagi menjadi empat kelompok. Yaitu gas, tanah, logam dan non logam. Pengelompokan ini masih terlalu umum karena ternyata dalam kelompok unsur logam masih terdapat berbagai unsur yang memiliki sifat berbeda.
Unsur gas yang di kelompokan oleh Lavoisier adalah cahaya, kalor, oksigen, azote ( nitrogen ), dan hidrogen. Unsur-unsur yang tergolong non logam adalah sulfur, fosfor, karbon, asam klorida, asam flourida, dan asam borak. Adapun unsur-unsur logam adalah antimon,perak, arsenik, bismuth. Kobalt, tembaga, timah, nesi, mangan, raksa, molibdenum, nikel, emas, platina, tobel, tungsten, dan seng. Adapun yang tergolong unsur tanah adalah kapur, magnesium oksida, barium oksida, aluminium oksida, dan silikon oksida.
Kelemahan dari teori Lavoisior : Pengelompokan masih terlalu umum
Kelebihan dari teori Lavoisier : Sudah mengelompokkan unsur yang ada berdasarkan sifat kimia sehingga bida dijadikan referensi bagi ilmuan-ilmuan setelahnya.
3. Pengelompokan unsur menurut J.W. Dobereiner
Pada tahun 1829, J.W. Dobereinern (Johann Wolfgang Dobereiner) seorang profesor kimia dari Jerman mengelompokan unsur-unsur berdasarkan kemiripan sifat-sifatnya.
Ia mengemukakan bahwa massa atom relatif strontium sangat dekat dengan masa rata-rata dari dua unsur lain yang mirip dengan strantium, yaitu kalsium dan barium. Dobereiner juga mengemukakan beberapa kelompok unsur lain seperti itu.
Unsur pembentuk garam dan massa atomnya, yaitu c1 = 35,5 Br = 80, dsn I = 127. unsur pembentuk alkali dan massa atomnya. Yaitu Li = 7, Na = 23dan K = 39.
Dari pengelompokan unsur-unsur tersebut, terdapat suatu keteraturan. Setiap tiga unsur yang sifatnya mirip massa atom ( A r ) unsur yang kedua (tengah) merupakan massa atom rata-rata dari massa atom unsur pertama dan ketiga.
Oleh karena itu, Dobereiner mengambil kesimpulan bahwa unsur-unsur dapat di kelompokan ke dalam kelompok-kelompok tiga unsur yang di sebut triade.
Kelemahan dari teori ini adalah pengelompokan unsur ini kurang efisian dengan adanya beberapa unsur lain dan tidak termasuk dalam kelompok triad padahal sifatnya sama dengan unsur dalam kelompok triefd tersebut.
Kelebihan dari teori ini adalah adanya keteraturan setiap unsur yang sifatnya mirip massaAtom (Ar) unsure yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsure pertama dan ketiga.
4. Hukum Oktaf Newlands
J. Newlands (John Alexander Reina Newlands) merupakan orang pertama yang mengelompokkan unsur-unsur berdasarkan kenaikan massa atom relatif. Newlands mengumumkan penemuannya yang disebut hukum oktaf.
Ia menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya. Daftar unsur yang disusun oleh Newlands berdasarkan hukum oktaf didasarkan pada tabel di bawah, :
Di sebut hukum Oktaf karena beliau mendapati bahwa sifat-sifat yang sama berulang pada setiap unsur ke delapan dalam susunan selanjutnya dan pola ini menyurapi oktaf musik.
Cara Mengahafal Tabel Periodik
Kali ini jatikom mau share cara mudah menghafal tabel periodik dalam pelajaran kimia SMA dengan cara jembatan keledai. Apa sih yang dimaksud jembatan keledai? Jembatan keledai adalah cara untuk mengingat atau menghafalkan sesuatu yang digunakan dalam bidang pendidikan. Jembatan keledai sering berupa kata atau suku kata yang ditambahkan pada susunan kata yang ingin dihafal agar terbentuk kalimat dengan arti yang menarik atau masuk di akal .
Unsur golongan 1A (Alkali)

1.Hn
2.Li
3.Na
4.K
5.Rb
6.Cs
7.Fr
Jembatan Keledai :
- Hai LiNa Kau Rebut Calon Suami Fransiska
- Hari Libur Nanti Kita Rbut Celana Si Feri
- Haji Lina Kawan Rubi Cs frans
- Hiiii… Lina Kok RaiB! Calon Suaminya Frustasi!
- Haji Lina Naik Kuda Rebutan Ciuman sama Frans
- Hai Lina Kau Rebut Cinta Suci Fredy
- Halina Karo Robi Cs-se Francis
- HaLiNa Kawin Rubi Cs Frustasi
Unsur Golongan 2A (Alkali Tanah)
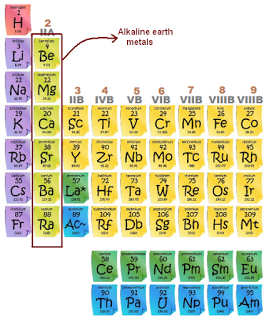
1.Be
2.Mg
3.Ca
4.Sr
5.Ba
6.Ra
Jembatan Keledai :
- Beli Mangga Casih Sribu Balik Ratusan
- Bemo Mogok Cari Sero Bawa Randa
- Beri Mangan Cari Sri Baginda Raja
- Bebek Mangan Cacing Seret Banget Rasane
- Bebek Mangan Cacing kesrempet Ban Radial
- Beli Mangga Campur Sirsak Bagi Rata.
- Bebek Mangan Cacing Sruduk Bakul Rawon
Unsur Golongan 3A (Boron/Aluminium)
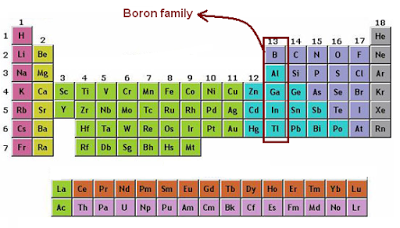
1.B
2.Al
3.Ga
4.In
5.Tl
Jembatan Keledai :
- Butet Adalah Gadis Indonesia Tulen
- Balga Intel!
- Bu Ali Ga Intelek
Unsur Golongan 4A (Carbon)
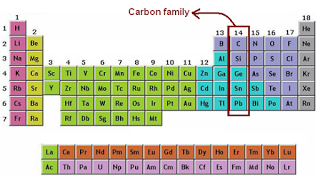
1.C
2.Si
3.Ge
4.Sn
5.Pb
Jembatan Keledai :
- Cewek Si Gendut Sedang Puber
- Cewek Si Gendut Seneng Plembungan
- Cah Sing Gendut Seneng Plembungan
Unsur Golongan 5A (Nitrogen)
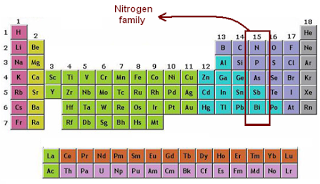
1.N
2.P
3.As
4.Sb
5.Bi
Jembatan Keledai :
- Nenek Pacaran Asyik Sabet Bibir
- Nona Parni Asyik Sibuk Bisnis
- NaPAS Sobo Bingi
Unsur Golongan 6A (Khalkogen)
1.O
2.S
3.Se
4.Te
5.Po
Jembatan Keledai :
- Orang Sinting Senang Telanjang Polos
- Orang Solo Senang TePo
- Orang Sebrang Senang Tembak Polisi
Unsur Golongan 7A (Halogen)
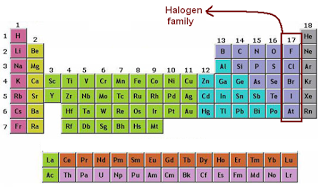
1.F
2.Cl
3.Br
4.I
5.At
Jembatan Keledai
- Fire Club Baru Ingin Atraksi
- Fatimah Cluyuran Broto Isin Atine
Unsur Golongan 8A (Gas Mulia)
1.He
2.Ne
3.Ar
4.Kr
5.Xe
6.Rn
Jembatan Keledai :
- Helen Nenek Arnold Kurus Xeperti Ranting
- Hebat, Negara Arab Keren, SeXe Ratunya
- Hei Nek Arep Kramas Xerano Rinso
- Heboh Negara Argentina Karena Xerong MaradoNa